Интенсивность окраски растворов можно измерять визуальным и фотоколориметрическим методом. Визуальные методы в значительной степени субъективны, так как сравнение интенсивности окрашивания растворов проводят невооруженным глазом. Приборы, предназначенные для измерения интенсивности окраски визуальным методом, называют колориметрами. К визуальным колориметрическим методам относят: 1) метод стандартных серий; 2) метод колориметрического титрования; 3) метод уравнивания; 4) метод разбавления.
Метод стандартных серий (метод цветной шкалы). Приготавливают ряд стандартных растворов какого-либо вещества с постепенно изменяющимися концентрациями в определенном объеме растворителя, например 0,1; 0,2; 0,3; 0,4; 0,5 мг и т. д. до ~ 10 шт. Помещают определенный объем каждого стандартного и такой же объем анализируемого раствора в пробирку, добавляют равные объемы необходимых реактивов. Сравнивают интенсивность полученной окраски исследуемого и стандартных растворов. Если окраска анализируемого раствора по интенсивности совпадает с цветом стандартного раствора, содержащего 0,4 мг данного вещества, то содержание его в исследуемом растворе равно 0,4 мг. Если окраска исследуемого раствора соответствует промежуточной концентрации, например между 0,4 и 0,5 мг, то концентрацию анализируемого раствора берут средней между соседними концентрациями стандартных растворов (приблизительно 0,45 мг). Рекомендуется для получения более точных результатов приготовить промежуточные серии стандартных растворов.
Метод дает приближенные результаты и во время работы необходимо часто возобновлять шкалу из-за неустойчивости окраски некоторых стандартных растворов. При выполнении анализа методом стандартных серий не требуется соблюдения основного закона колориметрии.
Метод колориметрического титрования (метод дублирования). Определенный объем анализируемого окрашенного раствора неизвестной концентрации сравнивают с таким же объемом воды, к которой добавляют из бюретки окрашенный стандартный раствор того же вещества определенной концентрации до уравнивания интенсивности окрасок. По совпадению интенсивности окрасок стандартного и исследуемого растворов определяют содержание вещества в растворе неизвестной концентрации. Концентрацию вещества в анализируемом растворе с х (в г/мл) находят по формуле

где Г--титр стандартного раствора, г/мл; V--объем стандартного раствора, мл; V1--объем анализируемого раствора, взятый для колориметрирования, мл.
Метод неприменим при реакциях, протекающих медленно, и при необходимости дополнительных обработок (кипячение, фильтрование и др.).
Метод уравнивания. Сравнение интенсивности окрасок анализируемого и стандартного растворов проводят в колориметрах. Метод основан на том, что, изменяя толщину слоя двух растворов с различной концентрацией одного и того же вещества, добиваются такого состояния, при котором интенсивность светового потока, прошедшего через оба раствора, будет одинакова-- наступает оптическое равновесие. Оптическая плотность каждого раствора соответственно равна:
Метод уравнивания является наиболее точным методом колориметрирования.
Метод разбавления. Одинаковую интенсивность окраски анализируемого и стандартного растворов получают путем постепенного разбавления водой или соответствующим растворителем того раствора, который более окрашен.
Разбавление проводят в одинаковых узких цилиндрах с делениями на миллилитры и десятые доли. Два одинаковых по размерам и формам цилиндра с анализируемым и стандартными растворами помещают рядом в специальный штатив с экраном из матового стекла. В более интенсивно окрашенный раствор вливают воду или растворитель до тех пор, пока окраска обоих растворов не станет одинаковой. После совпадения окрасок растворов измеряют объемы растворов в цилиндрах и рассчитывают содержание веществ в растворе неизвестной концентрации.
Метод колориметрического определения С02 по Спектору и Доджу можно использовать для анализа небольших количеств воздуха; он меньше подходит для серийных анализов. Метод основан на ослаблении окраски 0,0001 н. раствора МаОН, окрашенного в красный цвет в присутствии избытка фенолфталеина, при действии С02 вследствие увеличения концентрации ионов водорода. В 0,0001 н. раствор ЫаОН добавляют спиртовый раствор фенолфталеина до тех пор, пока значение светопропускания для раствора в кювете (100 мм) колориметра или спектрофотометра при длине волны 515 нм станет равным 10%.[ ...]
Колориметрическим методом пользуются при анализе прозрачных и слегка мутных проб; весовой метод применяется при анализе сточных вод, особенно в тех случаях, когда надо определить раздельно растворенную и нерастворенную кремневую кислоту.[ ...]
Колориметрический метод определения N0 основан на образовании азотсоединения красного цвета при взаимодействии нитритов с реактивом Грисса (сульфаниловая кислота и а-нафтиламин). Эта реакция отличается высокой чувствительностью и позволяет обнаруживать тысячные доли милиграмма нитритов в 1 л воды (при содержании в анализируемой воде нитритов более 0,3. мг/л воду необходимо разбавить). Анализ выполняют на фотоколориметре с зеленым светофильтром.[ ...]
Метод анализа, основанный на сравнении качественного и количественного изменения световых потоков при их прохождении через исследуемый и стандартный растворы, называется колориметрическим. Это общее определение. Однако если подойти более строго, то данный метод основан на измерении ослабления светового потока, происходящего вследствие избирательного поглощения света определяемым веществом, и правильнее называть его абсорбционным спектральным анализом, Существуют спектрофотометрический и фотометрический методы абсорбционного анализа. Первый основан на измерении в монохроматическом потоке света (свет с определенной длиной волны /.), а второй - на измерении в не строго монохроматическом пучке света. Если рассматривать вопрос под таким углом зрения, то колориметрия - метод, основаный на измерении в видимой части спектра. Но мы под колориметрией будем подразумевать все методы определения концентрации вещества в растворе по поглощению света.[ ...]
Колориметрический метод рекомендуется для анализа прозрачных и слегка мутных вод, содержащих от 0,4 до 05 мг/л SiCb. Этот интервал может быть увеличен разбавлением исходной воды. Колориметрическим методом можно определить растворенные ортосиликаты, а также все растворенные силикаты реакцией с молибдатом после гидролиза в щелочной среде.[ ...]
Колориметрический метод с экстракцией диэтилдитиокарбамата меди хлороформом и прямой метод определения с тетраэтилгиурам-дисульфидом рекомендуются для анализа питьевых и поверхностных вод, а после минерализации пробы - и для анализа сточных вод, содержащих медь в концентрациях от 0,01 до 5 мг в 1 л. Полярографический метод применяется для определения меди в концентрациях, превышающих 0,05 мг/л, и особенно рекомендуется для определения меди в присутствии других металлов.[ ...]
Колориметрический метод. Анализ начинают с построения калибровочного графика, для чего используют растворы альбумина или казеина.[ ...]
Колориметрические методы долгое время были одними из основных при анализе органических примесей в воздухе рабочей зоны и атмосферы. Высокая селективность химических реакций позволяет и сегодня использовать многие из них (см. гл.[ ...]
Анализы воздуха для определения содержания элементарного хлора, как правило, проводят на рабочих местах предприятий. Из-за сильного раздражающего действия хлора интерес представляют низкие концентрации 0,1-1 млн-1. Обычные колориметрические методы для этого диапазона концентраций основаны на окислительных реакциях, которые не специфичны для хлора, поскольку присущи и другим окислителям, таким, как 1 Ю2 и оаон. Так как речь в первую очередь идет об исследованиях на производствах, где характер присутствующих вредных веществ не вызывает сомнений, это нельзя считать большим недостатком.[ ...]
Колориметрическим и спектрографическим методами с чувствительностью. 0,05 мг/л, а также методами объемного анализа .[ ...]
Анализ малых концентраций галогенорганических соединений в воздухе основывается преимущественно на отщеплении галогена каталитическим сожжением в кварцевой трубке, в ламповом приборе в виде раствора вещества в горючем растворителе, а в возможных случаях его омылением. Последующее определение галогена производится нефелометрически в виде галогенида серебра или колориметрически по цветной реакции с роданидом ртути(II). Известен способ окисления хлорпроизводных хромовой смесью с последующим улавливанием и определением свободного хлора. В настоящее время значительное внимание уделяется цветным реакциям с целью разработки чувствительных фотометрических методов непосредственного определения соединения.[ ...]
Колориметрический метод анализа основан на измерении окраски раствора или изменении его оттенка после прибавления к нему того или иного реактива.[ ...]
Колориметрический метод анализа может быть осуществлен визуально (простым глазом) и объективно с помощью фотоколориметров.[ ...]
Колориметрический метод определения калия основан на окислении дихроматом выделенного в осадок гексанитрокобальта (III) натрия и калия с последующим определением интенсивности окраски раствора на фотоэлектроколориметре или визуально в цилиндрах Несслера. Обязательным условием проведения анализа являются фильтрование пробы и концентрирование ее при содержании калия менее 100 мг/л. Анализу мешают ионы аммония, кремнекислота и органические вещества.[ ...]
При анализе почв основное различие между методами чаще всего состоит в применении различных растворов (вода. соли, кислоты в разной концентрации) для извлечения из почвы того или иного элемента, так как его количественное содержание в вытяжке может быть определено в ряде случаев общепринятыми в химии приемами. Например, калий, извлекаемый по методу Кирсанова 0,2-нормальной соляной кислотой, практически можно учесть объемным методом (при титровании), на пламенном фотометре и колориметрически. Основные методы агрохимического анализа почв приведены в табл. 98.[ ...]
Для анализа мутных, окрашенных вод или вод, содержащих вещества, мешающие определению, используют колориметрический метод с предварительн й отгонкой фтора.[ ...]
Для анализа задержанных поглотителями загрязняющих воздух примесей часто применяют различные физико-химиче-ские методы. Нужно иметь представление о методах - колориметрическом, спектрофотометрическом, нефелометрическом, люминесцентном, хроматографическом, полярографическом, спектрографическом и некоторых других. Более детально ознакомиться с методикой можно по книгам М. В. Алексеевой и Е. А. Перегуд, Е. В. Гернет . Особо следует остановиться на экспрессных методах определения воздушных загрязнений.[ ...]
Для анализа проб газа в подобных газоприемниках целесообразно применять такие методы, при которых реагент в виде раствора вводится под давлением в заполненный пробой воздуха приемник. Затем в результате многократного встряхивания реагент либо абсорбирует некоторые содержащиеся в воздухе газы, либо вступает с ними в реакцию; после этого проводят колориметрический анализ. Процесс абсорбции может быть значительно ускорен путем добавления к реагенту инертного пенообразующего вещества, например раствора арилалкилсуль-фоната , в таком количестве, которое достаточно для образования во время встряхивания сосуда тонкодисперсной пены.[ ...]
При анализе относительно концентрированных сточных вод (а иногда и разбавленных) используют титриметрические методы анализа с применением как цветных индикаторов для фиксирования конца титрования, так и специальных приборов - электрохимических (потенциометрическое титрование, ампёрометрическое, кондуктометрическое и т. п.) и оптических (турбидиметрическое титрование, нефелометрическое, колориметрическое). Титриметрические методы часто применяют для определения анионов, особенно тогда, когда одновременно присутствуют разные анионы, мешающие определению друг друга (см. разд. 10).[ ...]
Ход анализа. Обработка проб, взятых а с п -рационным методом. Поглотительную жидкость из каждого поглотителя анализируют отдельно. Для этого берут по 1,0 мл испытуемой жидкости в три колориметрические пробирки; таким образом, анализируют половину взятой пробы.[ ...]
При анализах воздуха высокочувствительными методами необходимо учитывать, что если определяемая величина ока-зывается близкой к чувствительности метода, то ошибка определения может быть весьма ощутимой. Во избежание этого следует, например, применяя колориметрические методы, использовать по возможности калибровочный график или сравнивать интенсивность окраски со шкалой в средней части графика пли шкалы .[ ...]
Этот метод использован главным образом в конструкции автоматического анализатора для окислов азота. Чувствительность такого метода анализа колеблется от 0,005 до 5 частей на миллион по объему; используя колориметрический реагент, можно фотоэлектрически измерить полученный цвет.[ ...]
Быстрые методы анализа растений, когда вытяжки приготовляют из сырого материала и после обработки их реактивами сравнивают со шкалой стандартных растворов в пробирках, и особенно упрощенные методы анализа сока при капельном колориметрическом определении менее точны, чем методы валового анализа (весовые, объемные и др.).[ ...]
Известные методы анализа оловоорганических соединений основаны на их разрушении и определении олова. Такой косвенный способ с колориметрическим окончанием предложен для определения органических соединений олова в сточных водах ; для определения олова используется чувствительная реакция с фенилфлуороном, однако метод сравнительно сложный и не отличается точностью. В связи с этим для определения оловоорганических соединений в сточных водах значительный интерес представляет полярографический метод, как более простой, специфичный и точный.[ ...]
Поскольку анализ атмосферного воздуха часто связан с необходимостью продолжительных отборов, с присутствием различных примесей в атмосфере и с необходимостью хранения и транспортировки проб, то вторая группа методов более перспективна для этих целей. Несомненный интерес в этой группе методов представляет метод с использованием реагентов TGS-ANSA, обладающий определенными преимуществами по сравнению с другими методами. К его серьезным недостаткам относится использование труднодоступного реагента (ANSA), ядовитого метилового спирта, а также обладающего сильным и неприятным запахом гваякола. Хотя эти недостатки не носят принципиального характера, они могут быть препятствием для широкого внедрения метода. Преимуществом метода Полежаева-Гириной является простота и доступность используемых реагентов, но он также не лишен недостатков: он требует большого расхода сравнительно дорого стоящего иодида калия, поглотительные растворы неустойчивы под действием сильных окислителей и прямых солнечных лучей. К тому же указания на возможную канцероген-ность нафтиламинов дают серьезные основания для поиска других, безвредных колориметрических реагентов.[ ...]
При выборе метода количественного определения нефтепродуктов в сточной воде основными требованиями являются чувствительность и возможность широкого применения в практике. Приведенные в табл. 5.1 методы анализа различаются между собой.[ ...]
Определяется колориметрическим методом с чувствительностью 0,001- 0,002 мг/л и спектрометрическим . По данным , чувствительность определения бериллия в водных растворах после обогащения проб составляет при спектральном анализе 10-8% (с точностью 5%). После обогащения проб определяется физико-химическими методами анализа .[ ...]
Предлагаемый колориметрический метод, как и кьельдалевский метод «мокрого» сожжения, не применим для анализа соединений, содержащих азот в окисленной форме (-Ж)2; -N0; -и т. д.), и для азотистых гетероциклов (пиридин и т. п.).[ ...]
Краткая оценка методов определения микроэлементов. Количественное определение микроэлементов в биологических субстратах может быть выполнено методами химического, колориметрического, полярографического и спектрального анализа (метод радиоактивационного анализа здесь не рассматривается). Каждый из них по сравнению с другими имеет как преимущества, так и недостатки. Зайдель (1965) и Шустов (1967) считают эмиссионный спектральный анализ наиболее совершенным методом для одновременного количественного определения большого числа микроэлементов. Благодаря высокой чувствительности и точности он дает возможность по небольшой навеске золы получить данные о качественном и количественном составе микроэлементов в анализируемой пробе. Применение этой методики в технике и медицине показало, что она является более производительной, универсальной и не менее точной, чем химический анализ, который требует отдельных специфических реакций для определения каждого элемента. Поэтому химический анализ наиболее целесообразен при определении одного или нескольких элементов при значительном содержании каждого из них в изучаемом веществе. Полярографический метод по точности и чувствительности не уступает спектральному. Однако он требует сложной химической подготовки проб к анализу и менее удобен при определении качественного состава микроэлементов. Колориметрический метод отличается простотой и доступностью, однако является менее точным и документальным.[ ...]
Основным принципом методов измерения, применяемых при колориметрическом и турбидиметрическом анализах, является поглощение в видимой части спектра. Как было показано, эти анализы могут быть использованы для определения газов и пылевых частиц. Эти методы часто обладают достаточной специфичностью, хотя иногда приходится изолировать и концентрировать исследуемое вещество, чтобы избежать помех вследствие присутствия других соединений.[ ...]
Важнейшими условиями для колориметрического метода анализа являются: устойчивость вещества при разбавлении раствора, избирательность реакции для исследуемого вещества, устойчивость окраски растворов во времени, достаточном для колориметрического определения, воспроизводимость окраски, пропорциональность между интенсивностью окраски и концентрацией вещества в растворе (соблюдение основного закона колориметрии). Однако некоторые методы колориметрического анализа не требуют соблюдения этого закона, например метод стандартных серий.[ ...]
Овладение физико-химическими методами исследования объектов окружающей среды невозможно без соответствующего лабораторного практикума. Такой практикум должен проводиться на современном теоретическом и практическом уровне в отношении как инструментальной техники, так и выбора объектов и методов обработки экспериментальных данных. Между тем пособий по такого рода практикуму до сих пор нет. Используемые в настоящее время колориметрические методы отличаются большой продолжительностью проведения анализа, субъективностью, не обладают экспрессностью, не позволяют автоматизировать процесс анализа. Результаты анализов, выполненных этими методами, невозможно регистрировать на приборах, они не определяют совокупность всех токсичных ингредиентов, содержащихся в одной пробе. Этих недостатков лишены описываемые в данном справочнике физико-химические методы анализа объектов окружающей среды.[ ...]
Основным недостатком рассмотренного колориметрического метода определения оксидов азота является необходимость стандартизации реагентов. Метод не может быть использован в качестве экспрессного из-за длительности его проведения. Для анализа воздуха в условиях, когда возможно быстрое изменение концентрации оксидов азота, например на автомобильных дорогах, необходимо применять другие инструментальные методы, например метод хемилюминесценции. Колориметрический метод определения N0 и Ы02 может быть использован для контроля выбросов из стандартных источников загрязнений, а также для анализа стандартных газовых смесей для калибровки хемилюминесцентных газоанализаторов .[ ...]
Неплохие результаты дает и химический метод анализа соединений, элюируемых из хроматографической колонки ¡, причем для этой цели обычно применяют колориметрические реакции. Достоинство метода в том, что в реакцию вступает индивидуальное вещество хроматографического пика (при условии достаточно полного разделения смеси примесей), и эту одерацию можно повторять многократно. Недостатком метода является низкая чувствительность применяемых для этой цели колориметрических реакций (0,1-1,0 мкг), особенно при использовании капиллярных колонок, максимально допустимый объем пробы для которых значительно ниже, чем в случае насадочных хроматографических колонок. Кроме того, почти однйвременное фиксирование идентифицируемой примеси детектором и последующая реакция этого вещества на выходе из колонки не всегда возможны, так как в некоторых детекторах (ПИД, ПФД) происходит разрушение пробы, а другие например, ЭЗД) очень сильно реагируют на изменение давления, газа-носителя в хроматографической системе, неизбежное при подключении на выходе из колонки жидкостного поглотителя.[ ...]
Очень удобным и чувствительным является колориметрический метод для анализа воды с помощью роданида ртути, применяемый для анализа воздуха в лаборатории австрийского азотного комбината. Пробу воздуха пропускают со скоростью 30 л/мин через 30 мл 0,01 н. NaOH в любой промывной склянке (с пористой пластинкой, склянка Дрекселя, склянка-отражатель). Содержимое склянки переливают в мерную колбу вместимостью 50 мл, подкисляют 3 каплями 2 н. HN03, добавляют 4 мл раствора, содержащего 1 г роданида ртути (II) в 100 мл метанола, а также 8 мл раствора, содержащего 8 г железо(1П)аммониевых квасцов в 100 мл 6 н. HN03, доливают водой до метки и измеряют оптическую плотность этого раствора при 460 нм в кювете с толщиной слоя 1 или 5 см в зависимости от интенсивности окраски относительно холостого значения реактивов. Калибровочную кривую строят с помощью раствора NaCl, содержащего 10-20 мкг СГ/мл, в интервале 0-200 мкг СГ в 50 мл реактивного раствора. Определению мешают другие галогениды, циан и сульфид.[ ...]
Во всех случаях, когда только это возможно, используют простые колориметрические методы анализа на базе компаратора с цветными стандартными образцами, позволяющими быстро получить результат в миллиграммах на литр. В остальных случаях анализы проводят объемным методом с применением специальных бюреток и непосредственным отсчетом по ним результатов, выраженных во французских градусах.[ ...]
Азот в форме нитритов и нитратов в природных и обработанных водах обычно определяют колориметрическими способами. Например, обычный анализ на нитрат проводят с использованием сульфофеноло-вого реактива. Интенсивность желтой окраски, появляющейся в результате реакции с нитратами, прямо пропорциональна их концентрации в пробе. Окрашенная проба с неизвестной концентрацией сравнивается со стандартными растворами с известными концентрациями (используют цилиндры Несслера, колориметр или спектрофотометр). Анализ на нитрит основан на появлении красно-пурпурной окраски, появляющейся в результате реакции нитрита с двумя органическими реагентами - сульфаниловой кислотой и 1-нафтиламингидрохлоридом. Проведение анализов на нитриты и нитраты в сточных водах намного труднее из-за высоких концентраций различных примесей, таких, как хлориды и органические вещества. В «Стандартных методах» описано пять методов анализа на нитраты. Каждый из них включает специальную предварительную очистку сточной воды для отделения взвеси, устранения окраски и удаления других ингибирующих веществ.[ ...]
Для многих растений, в частности хлебных злаков, некоторых трав, плодовых и ягодных культур, применение метода диагностики потребности их в удобрениях по анализу сока стеблей, черешков или листьев затруднено или вследствие недостаточной сочности их стеблей и листьев, или отсутствия черешков, а иногда также из-за интенсивной зеленой окраски сока, мешающей колориметрическим определениям. Для таких растений В. В. Церлинг предложила быстрый метод анализа при помощи микрореакций на срезах растений. Ею разработана полевая лаборатория, выпускаемая в виде портативного прибора под названием ОП-2 (Церлинг). Этот прибор позволяет очень быстро определять в растении содержание нитратов, минеральных фосфатов и калия. Анализы просты по технике выполнения.[ ...]
Каротин не растворяется в воде, плохо растворим в спирте, но хорошо - в других органических растворителях: ацетоне, бензине, эфире. Метод анализа основан на извлечении каротина из навески бензином, адсорбционном отделении других красящих веществ (хлорофилла и ксантофилла) и колориметрическом сравнении полученного окрашенного испытуемого раствора с одновременно приготовленным образцовым, имитирующим каротин раствором (двухромовокислого калия).[ ...]
Определение величины ХПК не требует специальных приборов, но занимает много времени. Были предложены различные ускоренные варианты метода, а также методы анализа очень мало загрязненных вод. В настоящей статье рассматривать подробности всех этих вариантов мы не будем, отметим лишь, что предлагаемые приемы (увеличение концентрации серной кислоты для ускорения реакции, переход на колориметрическое окончание взамен титриметрического, применяемого при определении малых величин ХПК) достигают цели. Однако при использовании сер-ной кислоты (больших концентраций) требуется периодическое сравнение получаемых результатов с результатами, которые дает стандартный метод, и введение необходимых поправочных коэффициентов. Разработаны и автоматические методы определения величин ХПК с различными окончаниями: потенциометрическим, газометрическим и др.[ ...]
Реакционная масса после конденсации фенолята натрия с моно-хлорацетатом натрия содержит 21-24% феноксиуксусной кислоты (ФК) и 2,50-4,0% фенола1. В описанных в литературе методах анализа в конденсированной массе обычно определяют непрореагировавший фенол колориметрически с 4-аминоантипирином2 и, исходя из полученных результатов, рассчитывают выход ФК. Указанный метод применим только для определения малых количеств фенола, поэтому на практике навеску реакционной массы многократно разбавляют дистиллированной водой с целью достижения концентрации фенола, приемлемой для проведения анализа.[ ...]
В том случае, когда надо определить количество отдельных сахаров или групп сахаров (гексозы и пентозы), отделив их от других редуцирующих веществ, применяют хроматографический метод. Анализ этим методом состоит из двух частей: 1) разделение редуцирующих веществ с помощью хроматографии на бумаге и 2) определение количества сахара, выделенного на бумажной хроматограмме, колориметрическим методом или эбу-лиостатическим потенциометрическим методом.[ ...]
Недостаточная чувствительность, особенно для малых концентраций, влияние разнообразных примесей (■белков, сульфатов и т. п.), длительность определений характерны для современных методов аналитического определения ПАВ в сточных водах. При анализе осадков сточных вод эти недостатки усугубляются, и определить концентрацию неионогенных ПАВ на активном иле в ряде случаев не удается. Колориметрическим методом с метиленовой синей не определяются анионные ПАВ с алкильными цепями длиной менее Сб-С7 и промежуточные продукты распада ПАВ. Чувствительность колориметрических методов определения неионогенных ПАВ также снижается с уменьшением длины оксиэтилированной цепи. Соединения с тремя-че-тырьмя молями окиси этилена и менее не дают окрашенных комплексов.[ ...]
Обращает также внимание, что данные по распаду в воде водоемов большинства неионогенных ПАВ (за исключением ОП) более или менее одинаковы, несмотря на имеющееся структурное различие, что, на наш взгляд, обусловливается несовершенством колориметрических методов анализа неионогенных ПАВ.[ ...]
На основе реакции Шиффа между солянокислым парарозанилином, формальдегидом и S02, с давних пор применяющейся в аналитической практике для обнаружения формальдегида и S02, в настоящее время разработаны и получили широкое распространение методы количественного колориметрического определения следов S02 при анализе воздуха. Чаще всего применяется способ Уэста и Геке , упоминаемый и в Рекомендации VDI № 2451. При этом авторы придерживаются указания Файгля относительно стабильности дисульфитмеркури-ионов 2 и в качестве жидкости для абсорбции S02 из пробы воздуха используют раствор тетрахлормеркурата натрия (из 2NaCl + HgCl3), в котором S02 остается стабильным даже в течение 24 ч.[ ...]
Возможность ликвидации окислов азота в окислительной и восстановительной среде была проверена в опытах по огневому обезвреживанию водных растворов азотной кислоты на стендовой циклонной установке МЭИ и на одной из опытно-промышленных установок. Анализ дымовых газов на окислы азота выполнялся колориметрическим методом с применением салициловой кислоты . Для оперативного контроля суммарного содержания окислов азота в дымовых газах использовался газоанализатор УГ-2. Все опыты на стендовой установке проводились с удельной нагрузкой 0,9 т/(м3 - ч), средний медианный диаметр капель составлял 180 мкм, коэффициент расхода воздуха варьировался в пределах от 0,81 до 1,11, температура отходящих газов изменялась от 860 до 1280° С. Концентрация азотной кислоты в растворе составляла около 5%.[ ...]
Молекулярные сита одни из немногих сорбентов, которые пригодны для эффективного! поглощения из воздуха микропримесей газообразных неорганических веществ. Цеолиты 5А и 13Х находят применение для концентрирования оксидов азота, а еще лучше использовать для этого сита 13Х, покрытые триэтаноламином . Оказалось, что цеолит 5А хорошо поглощает следовые количества сероводорода и диоксида серы [П1], причем этот адсорбент лучше, чем цеолит 13Х, сорбирует сероводород. Полного улавливания СО на этом сорбенте можно добиться и при комнатной температуре, применяя цеолиты типа Y, в которых катионы натрия замещены катионами серебра. Этот способ концентрирования оксида углерода с последующим газохроматографическим анализом десорбированных примесей уже нашел применение в практике промышленно-санитарного анализа . На цеолите ЗА можно избирательно концентрировать микропримеси метанола и аммиака для Последующего их определения хроматографическим или колориметрическим методом, а цеолит, содержащий ионы кадмия(II), является прекрасным адсорбентом для извлечения из воздуха очень малых количеств сероводорода .
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Министерство здравоохранения и социального развития РФ
Министерство Здравоохранения Оренбургской области
ГАОУ СПО «Оренбургский областной медицинский колледж»
Реферат на тему
«Колориметрические методы анализа. Общая характеристика. Примеры определения»
Пушишина Анастасия Константиновна
Оренбург 2012
1 .Определение колориметрии
3. Примеры определений
1. Определение колориметрии
Колориметрия (от лат. color -- цвет и греч. мефсю -- измеряю) -- физический метод химического анализа, основанный на определении концентрации вещества по интенсивности окраски растворов (более точно -- по поглощению света растворами).
Колориметрия -- это метод количественного определения содержания веществ в растворах, либо визуально, либо с помощью приборов, таких как колориметры.
колориметрия фотометрия свет спектроколориметрия
2. История возникновения колориметрии и фотометрии
Один из первых колориметров, созданный французским оптиком Жюлем Дюбоском, 1980.
Любопытная история возникновения колориметрии и фотометрии. Ю. А. Золотов упоминает, что Роберт Бойль (так же, как и некоторые ученые до него) использовал экстракт дубильных орешков, чтобы различить железо и медь в растворе. Однако, по-видимому, именно Бойль впервые заметил, что чем больше железа содержится в растворе, тем более интенсивна окраска последнего. Это был первый шаг к колориметрии. А первым инструментом колориметрии стали колориметры типа колориметра Дюбоска (1870), которые использовались вплоть до недавнего времени.
Более совершенные приборы -- спектрофотометры -- отличаются возможностью исследования оптической плотности в широком диапазоне длин волн видимого спектра, а также в ИК и УФ-диапазонах, с меньшей дискретностью длины волны (с использованием монохроматора).
Фотоколориметры и спектрофотометры измеряют величину пропускания света при определенной длине волны света. Контроль (обычно дистиллированная вода или исходный материал без добавления реагентов) используется для калибровки устройства.
Колориметрия широко применяется в аналитической химии, в том числе для гидрохимического анализа, в частности -- для количественного анализа содержания биогенных веществ в природных водах, для измерения pH, в медицине, а также в промышленности при контроле качества.
Фотоколориметрия -- количественное определение концентрации вещества по поглощению света в видимой и ближней ультрафиолетовой области спектра. Поглощение света измеряют на фотоколориметрах или спектрофотометрах.
3. Примеры определений
Колориметрические методы основываются на фотометрическом сравнении густоты окраски исследуемого раствора, рассматриваемого в пропущенном свете, с окраской нормального раствора, содержащего определенное количество этого красящего вещества, или же с окраской некоторой эмпирически подобранной окрашенной середины, принятой за норму. В основе К. лежат следующие положения:
1) светопоглощающая сила раствора окрашенного вещества в бесцветном растворителе растет пропорционально концентрации и толщине слоя жидкости, следовательно:
2) если приготовить два раствора разной концентрации того же красящего вещества в том же бесцветном растворителе, и найти такой толщины слои их, что рассмотренные в пропущенном свете они дадут одну силу света и окраски, то толщины этих слоев обратно пропорциональны содержанию в них красящего вещества. Всякое фотометрическое сравнение сводится к определению условий, при которых наступает равенство двух освещений, поэтому и в К., рассматривая свет, прошедший через слой нормальной жидкости, и свет, проходящий через слой исследуемой жидкости, мы меняем эти слои до тех пор, пока не получим равенства в силе пропущенного света. Так как поглощение окрашенными растворами лучей разного цвета (различной длины волны) растет неодинаково с увеличением содержания красящего вещества, то лишь при равенстве в силе пропущенного света наступит и равенство окраски; при невыполнении первого условия, цвета растворов будут слегка другие.
Довести два слоя раствора до равенства поглощения света можно: 1) добавляя при постоянной толщине слоя в один из них бесцветного растворителя до тех пор, пока сила пропущенного света и окраска его не будут одинаковы; по количеству прибавленного растворителя можно легко рассчитать отношение концентрации исследуемого раствора и нормального; 2) удлиняя более слабо окрашенный слой жидкости до тех пор, пока поглощение света двумя слоями раствора не будет одинаково; тогда обратное отношение высот слоев жидкости даст отношение их концентрации.
По первому методу, теоретически более совершенному, был устроен один из первых колориметров, а именно колориметр Гутон-Лабильярдьера, построенный Саллероном. Он представлял зачерненный внутри деревянный ящик, в одной из боковых стенок которого прорезаны были две щели, освещенные извне светом, отраженным от зеркала. За щелями стоят две одинаковой толщины кюветки с плоскими стеклянными стенками; в одной из них находится нормальная жидкость определенной концентрации, в другой исследуемый раствор. В противоположной стенке прорезаны отверстия для глаз наблюдателя, в поле зрения которого видны две окрашенные щели. Прибавляя в более крепкий раствор бесцветного растворителя из градуированной бюретки, наблюдатель стремится достигнуть равенства освещений и окраски щелей; по количеству прибавленного растворителя рассчитывается концентрация раствора. Неудобство этого прибора заключается в самом методе, причина же малой точности даваемых им результатов лежит в его конструкции; действительно, глаз способен легко сравнивать освещение и окраску лишь двух соприкасающихся полей, по мере же удаления их друг от друга трудность сравнения увеличивается. Удобнее колориметры, основанные на 2-м методе, например колориметр Вольфа, один из первых, построенных по этому типу. Он состоит из 2-х стеклянных трубок A и B, деленных на мм, закрытых снизу пришлифованными пластинками и снабженных кранами (фиг. 1).
Свет, идущий от зеркала C, проходит через трубки и, дважды отразившись в стеклянных призмах D , выходит двумя смежными пучками из верхней общей плоскости призм. Наблюдатель смотрит через направленную на эту плоскость лупу и видит поле зрения, разделенное линией -- гранью касания двух призм -- на две части; одна половина освещена светом, прошедшим через A , другая через B. В A , положим, наливают до некоторой высоты нормальный раствор, B наполняют исследуемым раствором и выпускают из A и B, посредством кранов, жидкости до тех пор, пока обе половины поля не окажутся одинаковыми и линия раздела не исчезнет. Тогда обратное отношение высот столбов жидкостей в A и B даст отношение их концентраций; для облегчения вычисления высоту столба менее концентрированной жидкости берут равным 100 мм. Дюбоск значительно упростил обращение с прибором, заменив краны двумя массивными стеклянными цилиндрами T, T (фиг. 2), с плоско отшлифованными основаниями, которые по желанию могут быть более или менее глубоко опущены в стаканчики C и C ; это дает возможность удобно менять толщину слоя жидкости между нижней плоскостью цилиндров и дном стаканчика, т. е. именно толщину слоя, через который проникает свет.
Этот тип приборов весьма удобен. Для увеличения их чувствительности рекомендуют пользоваться иногда дымчатыми стеклами, поставленными на пути лучей, или прозрачными (желатиновыми или коллодионными) окрашенными пленками, подобранными так по отношению к цвету растворов, чтобы различной толщины слои давали через них не только разную силу света, но и заметно разное окрашивание. Прибор можно еще улучшить, усовершенствовав фотометрическую часть его; так, в последнее время к К. применили принцип фотометра (см.) Бунзена, в виде, данном ему Луммером и Бродгуном (фиг. 3).
Луч G 1 , идущий из A , попадает в призму P , которая кончается частью шаровой поверхности с пришлифованной фасеткой; этой фасеткой P прижимается к другой призме p. Пучок лучей G 1 отражается внутри призмы и та часть его, которая попадает на фасетку, следует дальше черезp в лупу L; остальные лучи рассеиваются, отражаясь от шаровой поверхности. Пучок G 2 отражается лишь от частей призмы p, не соприкасающихся с фасеткой, лучи же попадающие в место соприкосновения проходят насквозь вверх. Глаз видит в поле зрения светлое пятно на темном фоне или темное пятно на светлом, смотря по тому, сильнее ли пучок G 1 или G 2 ; исчезновение пятна указывает на равенство освещения.
Значительной точности достигла К. с устройством поляризационных колориметров. Первый подобный прибор построен Дюбоском, но наиболее известен поляризационный колориметр Крюсса. Основные части его те же, что у колориметра Дюбоска, но, как видно по фиг. 4, лучи из A и B , проходя через поляризующую призму выходят двумя смежными пучками, поляризованными в двух перпендикулярных плоскостях; перед лупой поставлена анализирующая призма Николя (см.).
Если вращать Николеву призму, то попеременно то одно поле, то другое будут темнеть, но перед призмой вставлена еще двойная кварцевая пластинка, одна половина которой вращает плоскость поляризации вправо, другая влево; линия деления кварца перпендикулярна к линии деления световых пучков, и поэтому поле зрения представляется разделенным на 4 части. Ввиду того, что кварц вращает плоскость поляризации неодинаково для разных лучей, все поля будут вообще казаться разноокрашенными, и лишь в одном положении Николевой призмы все поля будут казаться одинаково освещенными, и накрест лежащие поля одинаково окрашенными. Если сосуды A и B будут наполнены жидкостями, то равенство освещения и окраски нарушится и восстановится лишь тогда, когда слои A и B будут эквивалентны, т. е. обратное отношение их толщин будет равно отношению их концентраций. Этот колориметр значительно точнее ранее описанных, так как глаз весьма чувствителен к одновременным переменам освещения и окраски двух смежных полей. Бывают случаи, когда указанные колориметрические методы не приводят к цели -- это когда нужно определить присутствие и количество красящего вещества, прибавленного для фальсификации окрашенной жидкости (так иногда окраску красного вина улучшают прибавлением фуксина); общий цвет раствора фуксиновых солей тот же, что у природного красного вина, поэтому обыкновенные колориметрические методы не дают в этом случае ответа. Тогда прибегают к спектроколориметрии, т. е. к сравнению состава света, прошедшего через нормальную жидкость, с составом света, прошедшего через испытуемую. Для этой цели оба пучка света разлагаются спектроскопом и сравнивают силы света различных частей полученных двух спектров. Первый спектроколориметр построен Крюссом (подробнее см. Спектральный анализ, Спектрофотометр).
Применения К. Колориметрическими методами пользуются в аналитической химии тогда, когда требуется быстро определить количественное содержание в растворе окрашенного вещества, или когда содержание этого вещества столь незначительно, что обыкновенными аналитическими методами его трудно определить; при этом иногда содержащееся в растворе вещество само не окрашено, но может быть переведено в окрашенное соединение. Основные условия для успеха колориметрического опыта: точно известный состав нормальной жидкости, отсутствие мути в жидкостях и равенство их t°; глаз наблюдателя должен быть неутомленным, между отдельными опытами должно дать глазу отдохнуть. Точность определения от 0,1-1,0%, чувствительность во многих случаях чрезвычайно велика. Примеры применения К.: 1) определение содержания медного купороса в растворе; если раствор слишком слабый (мало окрашен), то прибавлением нашатырного спирта в избытке переводят нормальный и исследуемый растворы в более сильно окрашенные растворы аммиачно-медной соли. 2) Определение содержания хлора в воде; к воде прибавляют раствора азотнокислого серебра -- выделившееся хлористое серебро придает раствору опалесцирующий молочный цвет, который сравнивается с цветом нормального раствора хлористого натра (поваренной соли), также обработанного азотнокислым серебром. 3) Содержание красящего начала в красильных деревах, в индиго, в кошенили и т. д.
К. служит также для определения содержания в крови красящего начала -- гемоглобина, для каковой цели строят особенные приборы -- гемометры. В промышленности К. пользуются часто для определения достоинства различных продуктов по их окраске, например для определения достоинства (степени очистки) керосина, смазочных масел, пива, вина и т. д., также, на сахарных заводах для определения обесцвечивающей способности животного угля и т. д. Для этих целей выработан целый ряд специальных типов колориметров, служащих каждый для одного из упомянутых испытаний.
Размещено на Allbest.ru
...Подобные документы
Исследование спектров поглощения электромагнитного излучения молекулами различных веществ. Основные законы светопоглощения. Изучение методов молекулярного анализа: колориметрии, фотоколориметрии и спектрофотомерии. Колориметрическое определение нитрита.
курсовая работа , добавлен 01.06.2015
Составляющие тока заряжения. Способ осуществления выборки. Виды импульсных методов. Нормальная импульсная вольтамперометрия: влияние адсорбции, достоинства и недостатки, используемые приборы и материалы, отличительные черты от дифференциально-импульсной.
контрольная работа , добавлен 07.06.2011
Понятие точечного источника света. Законы освещенности, поглощения Бугера, коэффициент поглощения. Использование для измерения освещенности фотоэлемента, величина тока которого пропорциональна освещенности фотоэлемента. Обработка экспериментальных данных.
лабораторная работа , добавлен 24.06.2015
Оптические свойства полупроводников. Механизмы поглощения света и его виды. Методы определения коэффициента поглощения. Пример расчета спектральной зависимости коэффициента поглощения селективно поглощающего покрытия в видимой и ИК части спектра.
реферат , добавлен 01.12.2010
Теория атомно-абсорбционных измерений: излучение и поглощения света, понятие линии поглощения и коэффициента поглощения, контур линии поглощения. Принцип работы лазера. Описание работы гелий-неонового лазера. Лазеры на органических красителях.
реферат , добавлен 03.10.2007
Применение фотоколориметрии в биологии, медицине, фармации. Природа и основные характеристики оптического излучения, закономерности поглощения света веществом. Понятие об оптической плотности, светопропускании, светопоглощении. Схема фотометра КФК-3.
методичка , добавлен 30.04.2014
Устройство фотометрической головки. Световой поток и мощность источника света. Определение силы света, яркости. Принцип фотометрии. Сравнение освещенности двух поверхностей, создаваемой исследуемыми источниками света.
лабораторная работа , добавлен 07.03.2007
Сущность и физическое обоснование явления люминесценции как свечения вещества, возникающего после поглощения им энергии возбуждения, основные факторы, оказывающие на него непосредственное влияние. Люминесцентные источники света - газоразрядные лампы.
реферат , добавлен 25.04.2014
Значение света для жизни на Земле. Теории о развитии света. Характеристика волновых свойств света. Применение интерференции и дифракции света, представления о его природе. Фотонная молекула как новая форма материи, устройство среды ее существования.
презентация , добавлен 07.05.2015
Теоретические основы акустики. Рождение, характеристика, специфические особенности, измерение и коэффициент поглощения звука. Дифракция света на ультразвуке в анизотропной среде. Схемы и характеристики ультразвуковой аппаратуры. Применение ультразвука.
Лабораторная работа №1
Тема: ОСОБЕННОСТИ МЕТОДОВ АНАЛИЗА И ВЫПОЛНЯЕМЫХ ОПЕРАЦИЙ. ОТБОР И ХРАНЕНИЕ ПРОБ
Цель: Изучить методы анализа проб воды на судне, отбор и хранение проб.
Особенности методов анализа и выполняемых операций
При использовании судовой экспресс-лаборатории СЛКВ пробы воды анализируются различными методами (см. табл. 1). При аналитическом химическом контроле пробы воды анализируются визуальным, визуально-колориметрическим, фотоколориметрическим, титриметрическим методами.
Таблица 1.1
Правила консервации и хранения проб
| Наименование показателя | Материал, из которого изготовлена ёмкость для отбора и хранения проб | Метод консервации | Максимальный срок хранения пробы с момента отбора | Примечание |
| Водородный показании. (pH) | -- | 6 час | Определение предпочтительнее проводить на месте отбора проб | |
| Железо общее | Полимерный материал или боросиликатное стекло | Подкисление соляной кислотой до pH <2 | 1 мес. | Рекомендуется определять сразу после определения неустойчивых показателей |
| Жёсткость общая | Полимерный материал или стекло | 24 час | Допускается хранение в течение 48 час | |
| Масло и нефтепродукты | Стекло | Экстракция ЧХУ на месте отбора пробы Добавление 2-4 мл ЧХУ на 1 л пробы. Объем добавленного ЧХУ учитывается при проведении экстракции. | 24 час | Емкость перед отбором проб должна быть промыта ЧХУ. |
| Фосфаты (полифосфаты) | Полимерный материал или стекло | Добавление 2-4 мл хлороформа на 1 л пробы | 24 ч | Охлаждение до 2-5 °С |
| Хлор остаточный | Полимерный материал или стекло | Определение следует проводить как можно скорее | ||
| Хлорид- анионы | Полимерный материал или стекло | 1 мес. | Охлаждение до 2-5°С Хранение в тёмном месте. | |
| Щёлочность | Полимерный материал или стекло | Охлаждение до 2-5°С | 24 ч | |
| Запах | Стекло | Охлаждение до 2-5°С | 6 час | |
| Цветность | Полимерный материал или стекло | Охлаждение до 2-5°С и хранение в темном месте | 24 час | Допускается определение на месте отбора проб |
| Мутность | Полимерный материал или стекло | 24 час | Предпочтительнее проводить определение на месте отбора проб | |
| Привкус | Стекло | 2ч | Определение проводят при отсутствии подозрений на бактериальное загрязнение и отсутствии вредных веществ в опасных концентрациях | |
| Удельная электропроводность | Полимерный материал или стекло | Охлаждение до 2-5°С | 24 ч | Предпочтительнее проводить определение на месте отбора проб |
Таблица 1.2
Поправочные множители для условий отбора проб без использования охладителей
| Давление в котле, кг/см 2 | Поправочный множитель «К» | Давление в котле, кг/см 2 | Поправочный множитель «К» |
| 0,92 | 0,69 | ||
| 0,88 | 0,67 | ||
| 0,85 | 0,66 | ||
| 0,83 | 0,65 | ||
| 0,81 | 0,64 | ||
| 0,79 | 0,63 | ||
| 0,77 | 0,62 | ||
| 0,75 | 0,61 | ||
| 0,74 | 0,60 | ||
| 0,72 | 0,59 | ||
| 0,71 | 0,58 | ||
| 0,70 | 0,57 |
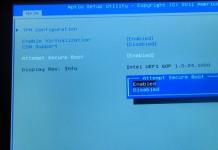
С ОФ = С колор х К = 50 х 0,79 = 39,5 мг/л
Вопросы для самоконтроля:
1. Методы анализа проб воды на судне.
Анализ визуальным методом
Визуальный метод анализа (оценки) - метод, основанный на получении информации невооруженным глазом либо с использованием оптических приборов (микроскопа, лупы). Визуальные методы относятся к органолептическим методам анализа.
Визуальный анализ воды (мутность, прозрачность) проводится при помощи градуированной стеклянной трубки и образца шрифта или юстировочной метки (рис.4) и основан на визуальном зрительном наблюдении объек4та (шрифта или метки) сквозь водяной столб при направленном достаточном освещении. Таким образом, определяют прозрачность воды в см - высота водяного столба, сквозь которую различим объект (шрифт или метка). Затем по градуировочному графику, который представляет собой кривую зависимости мутности и прозрачности воды, определяют мутность воды в единицах мутности ЕМ/л (ЕМФ) (по фармазину) или мг/л (по каолину).
Анализ колориметрическими методами
Колориметрический метод анализа основан на изменении поглощения света веществом, определении концентрации вещества по интенсивности окраски растворов.
Определяемый компонент при помощи химико-аналитической реакции переводят в окрашенное соединение, после чего измеряют интенсивность окраски полученного раствора либо сравнивают интенсивность окраски исследуемого раствора с окраской стандартного раствора и им плёночной контрольной шкалы. Интенсивность окраски является мерой концентрации анализируемого вещества. Если окраска пробы оценивается визуально, такой метод называется визуально-колориметрическим. При измерении интенсивности окраски проб с помощью прибора - фотоколориметра - метод называется фотоколориметрическим.
При выполнении анализа визуально-колориметрическим методом (pH, железо общее, жёсткость общая, фосфаты, цветность) определение проводится в колориметрических пробирках или склянках.
Колориметрические пробирки представляют собой обычные, широко используемые в лабораториях пробирки из бесцветного стекла диаметром 11-15 мм. Колориметрические пробирки и склянки могут иметь метки («5 мл», «10 мл»), показывающих объём в миллилитрах и, следовательно, уровень, до которого следует наполнить пробирку или склянку пробой, чтобы обеспечить необходимые условия визуального колориметрирования. Колориметрические пробирки и склянки для колориметрирования имеют одинаковую форму и диаметр, т.к. от этих параметров зависит высота слоя окрашенного раствора и, следовательно, интенсивность окраски.
Наиболее точные результаты при анализе визуально-колориметрическим методом достигаются, если сравнивать и риску пробы с окраской модельных растворов.
Визуальное колориметрирование пробы проводят, располагая колориметрическую склянку или пробирку на белом поле контрольной шкалы и, освещая склянку рассеянным белым светом достаточной интенсивности, наблюдают окраску раствора сверху (рис. 1.1).
Рис. 1.1. Проведение визуально-колориметрического определения по контрольной плёночной шкале с применением колориметрической пробирки (а) и колориметрической склянки (б), по шкале растворов-имитаторов (в).
За результат анализа при визуальном колориметрировании принимают значение концентрации эталонного раствора или образца окраски контрольной шкалы, наиболее близкого к окраске пробы анализируемой воды.
Нижегородская государственная сельскохозяйственная академия
НЕКОТОРЫЕ РАЗДЕЛЫ
Нижний Новгород 2006г.
Нижегородская государственная сельскохозяйственная академия
НЕКОТОРЫЕ РАЗДЕЛЫ
Методическое пособие по физическим разделу
Теоретических основ прогрессивных технологий (ТОПТ)
Для студентов экономического факультета
сельскохозяйственных ВУЗов
Нижний Новгород 2006 г.
УДК 539.19+536
НЕКОТОРЫЕ РАЗДЕЛЫ ОПТИКИ:
методическое пособие по физическиму разделу Теоретических основ прогрессивных технологий (ТОПТ). Для студентов экономического факультета сельскохозяйственных ВУЗов/ Нижегородская гос. с.-х. академия. -Нижний Новгород, 2006г.
Учебное пособие составлено в соответствии с действующими программами по ТОПТ для студентов экономических специальностей сельскохозяйственных ВУЗов и включает в себя теорию по некоторым разделам «Оптики».
Печатается по решению редакционно-издательского совета Нижегородской государственной сельскохозяйственной академии
Под редакцией д.б.н. профессора А. В.Чурмасова
Рецензенты: кафедра физики НГСХА;
© Нижегородская государственная
сельскохозяйственная академия, 2006г.
ГЕОМЕТРИЧЕСКАЯ
ОПТИКА
ФОТОМЕТРИЯ
ЗАКОНЫ ОТРАЖЕНИЯ И ПРЕЛОМЛЕНИЯ СВЕТА
Раздел оптики, в котором законы распространения света рассматриваются на основе представления о световых лучах, называется геометрической оптикой . Под световыми лучами понимают нормальные к волновым поверхностям линии, вдоль которых распространяется поток световой энергии.
На границе раздела двух прозрачных однородных сред свет частично отражается, а частично проходит во вторую среду, изменяя при этом свое направление. Закон отражения: отраженный луч лежит в одной плоскости с падающим лучом и перпендикуляром, проведенным к границе раздела двух сред в точке падения; угол отражения α равен углу падения β :
Направление распространения светового луча в этих средах определяется законом преломления Снеллиуса : преломленный луч лежит в той же плоскости, в которой находятся падающий луч и нормаль к разделу сред, восстановленная в точке падения; отношение синуса угла падения (α) и угла преломления (γ) есть величина постоянная для данной пары сред :
Значение постоянной величины (const) можно определить из волновой теории света (рис. 1). Пусть «ММ» - граница двух сред, в которых свет распространяется с разными скоростями v 1 и v 2 (причем v 1 > v 2). Под некоторым углом α на границу ММ падает параллельный пучок световых лучей. Выберем в этом потоке два луча SA и SB. AC – фронт падающих лучей. Согласно принципу Гюйгенса , каждую точку волнового фронта следует рассматри-
 ватькак самостоятельный источник новых волн
. Следовательно, но, пока второй луч SB дойдет до точки В, около точки А возникает полусферическая волна с радиусом AD, причем AD < CB, т. к. v 2 < v 1 . Фронтом новой волны
по принципу Гюйгенса
будет ВD – касательная, проведенная из точки B к AS′ – направлению преломленного луча, поэтому BD ┴ ADS′. Угол между нормалью к границе ММ и преломленным лучем ADS′ – угол преломления γ
. Из геометрических соображений (углы, образованные взаимноперпендикулярными сторонами) угол САВ равен углу α, угол ADB равен углу γ. Из прямоугольных треугольников АСВ и ADB можем написать: СВ = АВ·sin α ; AD = AB · sin α. Разделив эти уравнения, получим:
ватькак самостоятельный источник новых волн
. Следовательно, но, пока второй луч SB дойдет до точки В, около точки А возникает полусферическая волна с радиусом AD, причем AD < CB, т. к. v 2 < v 1 . Фронтом новой волны
по принципу Гюйгенса
будет ВD – касательная, проведенная из точки B к AS′ – направлению преломленного луча, поэтому BD ┴ ADS′. Угол между нормалью к границе ММ и преломленным лучем ADS′ – угол преломления γ
. Из геометрических соображений (углы, образованные взаимноперпендикулярными сторонами) угол САВ равен углу α, угол ADB равен углу γ. Из прямоугольных треугольников АСВ и ADB можем написать: СВ = АВ·sin α ; AD = AB · sin α. Разделив эти уравнения, получим:
Теперь разделим числитель и знаменатель левого отношения равенства (3) на промежуток времени Δt, за который свет проходит путь СВ в первой среде и путь AD во второй среде:
 (4)
(4)
Объединив уравнения (3) и (4), получим:
Так как абсолютный показатель преломления среды (n) равен отношению скорости света (с) в вакууме к скорости света (v) в данной среде, то можно записать:
Равенство (4) с учетом формул (5) примет вид:
 (7)
(7)
где n 21 - относительный показатель преломления двух сред. Соотношение (7) – закон преломления света на границе двух сред.
Показатель преломления является важной индивидуальной физической характеристикой вещества. Он принадлежит к тем физическим величинам, которые можно измерить с высокой степенью точности и небольшой затратой времени, располагая малым количеством вещества.
Оптические методы исследования веществ, основанные на измерении их показателей преломления, составляют самостоятельный раздел прикладной оптики – рефрактометрию . Рефрактометрические данные можно использовать для определения чистоты вещества и концентрации вещества в растворе, для идентификации различных веществ и т. п.
При переходе света (рис. 2а) из среды с меньшим показателем преломления (оптически менее плотная ) в среду с большим показателем преломления (оптически более плотная ) угол падения больше угла преломления
 |  |
(лучи 1 и 1′). Если угол падения луча 2 близок к прямому (α = 90˚, луч ْ 2 скользит вдоль границы раздела сред), то он будет преломляться под углом γ пр (луч 2′). Этот угол является наибольшим углом преломления для данных сред и называется предельным углом преломления . Из закона преломления следует:
Если свет переходит из оптически более плотной среды в оптически менее плотную (рис. 2б), то угол преломления больше угла падения (лучи 3 и 3′). При некотором угле падения α пр (луч 4) угол преломления равен 90˚, т. е. преломленный луч 4′ скользит вдоль границы сред. При дальнейшем увеличении угла падения света луч 5 полностью отражается (луч 5′) от границы сред возникает явление полного внутреннего отражения . Из формулы (7):
Угол α пр называется предельным углом полного отражения . Из формул (8) и (9) следует, что γ пр и α пр для данных сред зависят от их абсолютных показателей преломления. Это применяется на практике в приборах для измерения показателя преломления веществ – рефрактометрах .
ЛУПА И МИКРОСКОП
Линзы представляют собой прозрачные тела, ограниченные двумя поверхностями (одна из них обычно сферическая, иногда цилиндрическая, а вторая сферическая или плоская), преломляющими световые лучи, способные формировать оптические изображения предметов. Материалом для линз служат стекло, кварц, кристаллы, пластмассы и т. п. По внешней форме линзы делятся на: 1) двояковыпуклые; 2) плосковыпуклые; 3) двояковогнутые; 4) плосковогнутые; 5) выпукло-вогнутые; 6) вогнуто-выпуклые. По оптическим свойствам линзы делятся на собирающие и рассеивающие . Линза называется тонкой , если ее толщина (расстояние между ограничивающими поверхностями) значительно меньше по сравнению с радиусами поверхностей, ограничивающих линзу. Формула тонкой линзы :
Фокусное расстояние линзы:
f =  (11)
(11)
Точки F, лежащие по обе стороны линзы на расстоянии, равном фокусному, называются фокусами линзы . Фокус − это точка, в которой после преломления собираются все лучи, падающие на линзу параллельно главной оптической оси (прямая, проходящая через центры кривизны поверхностей линзы).
Величина Ф, рассчитываемая по формуле (12) называется оптической силой линзы . Диоптрия − оптическая сила линзы с фокусным расстоянием 1 м: 1 дптр = 1/м. Линзы с положительной силой являются собирающими , с отрицательной − рассеивающими .
Учитывая (12) формулу тонкой линзы можно записать в виде:
Микроскоп является одним из важнейших лабораторных приборов в биологических и медицинских исследованиях. Микроскоп широко применяется для наблюдений и исследования таких объектов, которые невозможно различить невооруженным глазом.
Глаз человека – сложная и совершенная оптическая система. Особенности строения глаза и получения изображения объекта на сетчатке глаза подробно разбираются в указанной литературе. В целом оптическая система глаза действует как собирающая линза с переменным фокусным расстоянием. Размер изображения на сетчатке глаза определяется углом зрения α (рис. 3а). Однако для малых (или удаленных) предметов угол зрения мал и детали предмета выявляются недостаточно.
 |
| (а) (б) Рис. 3 |
Оптические приборы, вооружающие глаз, позволяют увеличить угол зрения и поэтому более подробно различать детали предмета. Достигаемый при этом эффект характеризуется угловым увеличением Г прибора:
где α′ и α – углы зрения, под которым виден предмет соответственно через прибор и невооруженным глазом.
Простейшим оптическим прибором для рассматривания мелких предметов является лупа . Роль лупы выполняют также окуляры оптических приборов – микроскопа , спектроскопа , поляриметра и др.
Лупа – собирающая короткофокусная линза, которую располагают между предметом и глазом. Если невооруженным глазом рассматривать предмет АВ (рис. 3а) с расстояния наилучшего (ясного) зрения L =25 см, то он будет виден под углом α, причем
Поскольку глаз на практике располагают вблизи заднего фокуса лупы (рис. 3б), можно считать, что .
Подставив полученные значения tg α и tg α′ в формулу (1), получим выражение для углового увеличения лупы:
![]() (15)
(15)
Увеличение лупы обратно пропорционально ее фокусному расстоянию и показывает, во сколько раз увеличивается линейный размер изображения на сетчатке за счет применения лупы. На практике используются лупы не бо-
лее 20 – кратного увеличения (20 x). Более короткофокусные линзы дают искаженное изображение.
Оптическая система микроскопа состоит из объектива и окуляра, расположенных друг от друга на расстоянии 15 – 20 см на рисунке 4 схематически показан ход лучей в микроскопе.
Предмет АВ помещают чуть дальше переднего фокуса F об объектива Об, который дает действительное обратное и увеличенное изображение А′В′. Это промежуточное изображение попадает между окуляром Ок и его передним фокусом F ок. Его рассматривают через окуляр как через лупу. Окончательное изображение А′′В′′ получается
мнимым, увеличенным и прямым относительно А′В′, но обратным относительно самого предмета АВ. Положение объектива относительно предмета подбирается так, чтобы
 |
| Рис. 4 |
окончательное изображение А′′В′′ располагалось от глаза на расстоянии наилучшего (ясного) зрения L =25 см (рис. 5, на котором для наглядности не соблюдены относительные размеры основных параметров). Качество изображения во многом зависит от объектива. Хорошие объективы, в которых устранены недостатки, состоят из многих линз (иногда более 10), заключенных в общую оправу. Окуляр и объектив биологического микроскопа являются съемными и размещены на концах цилиндрической трубки – тубуса , укрепленного на массивном штативе. Расстояние между внутренними фокусами объектива и окуляра называется оптической длиной тубуса . Оптическая длина Δ тубуса короче его геометрической длины на сумму фокусных расстояний объектива и окуляра.
 |
| Рис. 5 |
Увеличение Г микроскопа равно произведению увеличений объектива и окуляра:
Окуляр используется как лупа, и его увеличение определяется формулой:
Увеличение объектива можно найти, рассматривая подобные треугольники ОАВ и ОА′В′ (см. рис. 4 и 5) и учитывая, что Δ >> f об:
 (18)
(18)
Следовательно, угловое увеличение микроскопа:
Объективы биологических микроскопов имеют угловое увеличение от 8 х до 90 х, окуляры – от 7 х до 15 х. Следовательно (см. формулу 16), угловое увеличение микроскопа лежит в пределах от 56 х до 1350 х. Угловое увеличение оптического микроскопа свыше 1000 х использовать нецелесообразно, так как при этом ухудшается качество изображения.
Линейным или поперечным увеличением К называется отношение линейных размеров (см. рис. 5) изображения X 2 = |A""B""| предмета X 1 = |AB|:
ЭЛЕМЕНТЫ ФОТОМЕТРИИ
Фотометрия – это раздел оптики, который изучает методы и приемы измерения видимого света (интервал электромагнитного излучения Δλ = 380 ÷ 760 нм).
Поток энергии, который несут световые волны, можно оценить двояко: 1) энергетически – как количество энергии, проходящей через данную поверхность в единицу времени (т. е. мощность P, измеряется в Ваттах), или 2) по зрительному ощущению. Мерой чувствительности глаза к свету различной длины волны можно характеризовать кривой видности (рис.6). Абсциссой этой кривой служат длины волн λ, а ординатой – коэффициенты видности V λ , т. е. величины обратно пропорциональных мощностям монохроматических излучений, равноярких с точки зрения визуальной оценки. Кривая видности имеет максимум при λ = 555 нм, условно принимаемый за 1; при удалении от максимума кривая быстро убывает к 0. Так, например, для λ = 670 нм требуется мощность, примерно в 30 больше, чем для λ = 550 нм, чтобы вызвать одинаковое по силе зрительное ощущение.
чечного источника 0 (его размеры малы по сравнению с расстоянием до места наблюдения и свет испускается равномерно по всем направлениям), на расстоянии r расположена малая площадка s, нормаль к которой составляет угол α с лучем. На площадку s от источника 0 попадает световой поток, ограниченный телесным углом Ω. Мерой телесного угла Ω служит отношение площади сферы Sсф, вырезаемой конической поверхностью на сфере произвольного радиуса r c центром в вершине 0 конической поверхности, к квадрату радиуса:
Измеряется Ω в стерадианах (ср).
Сила света I точечного источника света (в данном направлении) равна отношению светового потока Ф к величине телесного угла Ω:
Единицей измерения силы света служит кандела (кд). В СИ кандела является основной единицей.
Освещенностью E поверхности называется величина, равная отношению светового потока Ф, падающего на данную поверхность, к ее площади s:
Измеряется освещенность в люксах (лк).
Освещенность в разных точках поверхности может быть различна. Для вычисления освещенности следует воспользоваться формулами (21), (22), (23):
![]() (24)
(24)
Соотношение
называется законом освещенности от точечного источника света .
В таблице 1 сравнивается световые и энергетические единицы фотометрических величин.
Таблица 1
Яркость светящейся поверхности вычисляется по формуле:
где I − сила света элемента излучающей поверхности;
s − площадь проекции элемента излучающей поверхности на плоскость, перпендикулярную направлению наблюдения;
φ − угол между направлением излучения и нормалью к площадке ds.
Светимость определяется соотношением:
где Ф − световой поток, испускаемый поверхностью;
s − площадь этой поверхности.
Приборы, служащие для измерения световых величин, называются фотометрами . Если шкала фотометра проградуирована в единицах освещенности – люксах, прибор называется люксметром .
КОНЦЕНТРАЦИОННАЯ КОЛОРИМЕТРИЯ
Концентрационная колориметрия – это фотометрический метод определения концентрации вещества в окрашенных растворах, который связан с изменением интенсивности света.
Интенсивностью света называется отношение энергии W, переносимой светом через поверхность, перпендикулярную световому лучу, ко времени переноса t и к площади s этой поверхности:
Прохождение света через вещество ведет к возбуждению колебаний электронов среды под действием электромагнитного поля световой волны. Этот процесс сопровождается потерей энергии света, которая превращается в различные формы внутренней энергии вещества или в энергию вторичного излучения, и называется поглощением света . Поглощение света, например, может приводить к нагреванию вещества, ионизации или возбуждению атомов и молекул, фотохимическим процессам и т. п.
Поглощение света веществом обычно носит избирательный (селективный) характер: свет разных длин волн поглощается по-разному. Поэтому большинство окружающих нас тел имеет «собственный» цвет. Из потока белого света тело поглощает лучи только определенных длин волн, остальные отражаются, пропускаются или рассеиваются. Так, например, листья живых растений обладают значительным поглощением во всем видимом спектре, кроме 520 нм < λ < 600 нм (зеленая часть) и λ > 700 нм (темно-красная часть).
Избирательным поглощением стекла или полиамидной пленки обусловлен парниковый эффект : значительная часть инфракрасного излучения, испускаемого нагретой землей, поглощается стеклом (или пленкой) и, таким образом, задерживается внутри парника. Слой озона в верхних слоях атмосферы интенсивно поглощает ультрафиолет и тем самым защищает живую природу на Земле от губительного действия коротковолнового излучения. Биологические ткани, клеточные структуры, отдельные органические молекулы также сильно поглощают ультрафиолетовое излучение.
Закон поглощения света однородной средой выводится на основании экспериментальных наблюдений Бугера и Ламберта: уменьшение интенсивности при поглощении света на малом пути пропорционально длине этого пути и самой интенсивности. Если выбрать небольшой слой вещества толщиной dx (рис.8а), то ослабление интенсивности dI опишется (на основе опытных данных) следующей формулой:
где k – коэффициент поглощения зависит от рода вещества и длины волны света. Знак «-» означает, что интенсивность I света уменьшается за счет его поглощения.
 |
| Рис. 8 |
Чтобы определить полное изменение интенсивности света после его прохождения сквозь слой толщиной l, проинтегрируем уравнение (29), предварительно разделив переменные:

После потенцирования:
Соотношение (30) называется законом Бугера – Ламберта . При распространении света в веществе его интенсивность убывает по экспоненте (рис. 8б). В слое толщиной l = интенсивность света падает в e = 2,72 раза.
Для удобства практической оценки ослабления света при его прохождении сквозь образец пользуются понятиями:
коэффициента пропускания (31)
и оптической плотности (32)
Очевидно, что или (33)
Коэффициент поглощения определяется по формуле:
![]() (34)
(34)
Большое практическое значение имеет поглощение света растворами. Опытным путем установлено, что для веществ, растворенных в прозрачных растворителях, коэффициент поглощения (k) пропорционален их концентрации (С) в растворе (закон Бера ):
где А – коэффициент пропорциональности, постоянный в случае слабых растворов и зависящий от рода молекул растворенного вещества (при больших С этот коэффициент начинает зависеть от С и пропорциональная зависимость k(С) нарушается).
Поглощение света растворами описывается законом Бугера – Ламберта – Бера :
![]() (36)
(36)
Отсюда или ![]() (37)
(37)
где – 0,43А = ε (молярный коэффициент поглощения, характеризует поглощение света молярным раствором исследуемого вещества в слое единичной толщины) является важной физической характеристикой растворов.
Из соотношений (37) и (32) оптическая плотность раствора определяется следующей формулой:
Закон Бугера – Ламберта – Бера (формулы 36 и 38) лежит в основе концентрационной колориметрии и дает возможность: 1) определить концентрацию (С) вещества в растворе (при известных D и ε); 2) идентифицировать вещества(т. е. определить ε по известным D и С при облучении монохроматическим светом).
Для определения оптической плотности D растворов используют специальные приборы – колориметры . При этом фотометрирование проводят визуально или с помощью чувствительных фотоэлементов.
ВОЛНОВАЯ ОПТИКА
УРАВНЕНИЕ БЕГУЩЕЙ ВОЛНЫ
СТОЯЧИЕ ВОЛНЫ
Колеблющееся тело - источник колебаний (камертон, струна, мембрана и т. д.), находящееся в упругой среде, приводит в колебательное движение соприкасающиеся с ним частицы среды. Колебание этих частиц передается (силами упругости) соседним частицам среды и т. д. Через некоторое время колебание охватит всю среду. Процесс распространения колебательного движения в среде называется волной. Направление распространения волны (колебаний) называется лучом. Волна называется поперечной, если частицы среды колеблются перпендикулярно лучу. Если колебания частиц среды происходят вдоль луча, волна называется продольной .
Если точка 0 совершает колебательное движение в упругой среде по гармоническому закону (рис. 9):
у = А sin ωt, (39)
где y - смещение колеблющейся точки;
Соседняя точка В среды придет в. колебательное движение с некоторым запозданием на время:
где х - расстояние, на которое распространилось колебание от точки 0 до точки, В;
- скорость распространения колебания от 0 до В.
Тогда уравнение колебаний в точке В запишется:
y = А sin ω (1-τ) = А sin (ωt −) (41)
Соотношение (41), позволяющее определить смещение любой точки среды в любой момент времени, называется уравнением бегущей плоской синусоидальной волны .
Длиной волны (λ)называется расстояние между соседними точками, находящимися в одинаковой фазе, т. е. расстояние, пройденное волной за один период колебания , следовательно:
λ = vT = ; v = λν (42)
где ν - частота колебания частиц среды (частота волны). Колебания частиц среды имеют ту же частоту, что и колебания источника волн. Волны, частоты колебаний в которых лежат в пределах от 16 до 20000 Гц, называют звуковыми. В звуковой или акустической волне происходят механические колебания частиц среды с малыми амплитудами.
Подставляя в уравнение (41) v= и учитывая, что ω = = 2πν, получим другие формы записи уравнения волны:
y = А sin 2π(t/T-x/λ) = А sin 2π (νt- x/λ) = А sin(ωt - 2π x/λ), (43)
где - волновое число , которое показывает, сколько длин волн укладывается на отрезке длиной 2π. Тогда уравнение волны запишется:
y = А sin(ω t-kx) (44)
Метод определения скорости звука основан на свойствах звуковой стоячей волны . Стоячие волны образуются при наложении (интерференции) двух встречных плоских волн с одинаковой амплитудой. Практически стоячие волны возникают при отражении волн от преград. Падающая на преграду волна и бегущая навстречу отраженная волна, налагаясь друг на друга, дают стоячую волну.
Напишем уравнение двух плоских волн, распространяющихся вдоль оси X в противоположных направлениях:
y 1 = А sin (ωt-kx), у 2 = А sin (ωt + kx)
Сложив эти уравнения и преобразовав результат по формуле для суммы синусов, получим:
у = y 1 + у 2 = 2А cos k x sin ωt (45)
Заменим волновое число kего значением 2π/λ. Тогда уравнение (45) примет вид:
у = 2Асоs 2π sin ωt (46)
Уравнение (46) есть уравнение стоячей волны. Из этого уравнения видно, что в каждой точке стоячей волны происходят колебания той же частоты, что и у встречных волн, причем амплитуда (у max) зависит от х:
у max = 2А cos 2π
| (7) |
2π =±nπ (n = 0, 1,2, 3, ...), (47)
амплитуда колебаний достигает максимального значения (у max = 2А). Эти точки называются пучностями стоячей волны. Из (47) получаются значения координат пучностей:
x пучн = ± n (n = 0,1,2,3,…), (48)
В точках, координаты которых удовлетворяют условию
2π =±(n + )π (n = 0, 1,2, 3, ...),"
амплитуда колебаний обращается в ноль (у max = 0). Эти точки называются узлами стоячей волны. Точки среды, находящиеся в узлах, колебаний не совершают. Координаты узлов имеют значения
| (9) |
x узл = ±(n + ) (n = 0, 1,2, 3, ...), (49)
Из формул 48 и 49 следует, что расстояние между соседними пучностями, так же как и расстояние между соседними узлами, равно λ/2. Пучности и узлы сдвинуты друг относительно друга на λ /4.
ИНТЕРФЕРЕНЦИЯ СВЕТА
По современным научным представлениям, свет - это сложный электромагнитный процесс, обладающий как волновыми , так и корпускулярными свойствами. Настоящая работа базируется на наблюдении и изучении явления интерференции света, которое объясняется с позиций волновой теории света.
Интерференцией света называется такое сложение световых волн, в результате которого образуется устойчивая картина их усиления и ослабления .
НАЧАТЬ С → ↓
Рис. 10, формула 50
Для осуществления интерференции накладывающиеся волны должны удовлетворять условиям когерентности (согласованности по фазе световых колебаний в пучках света или отдельных частях пучка). Когерентными называются волны, имеющие одинаковые частоты и постоянную во времени разность фа з.
Реальные светящиеся тела испускают некогерентные волны. Так происходит потому, что поверхность любого светящегося тела состоит из множества точек (атомов), автономно, прерывно и случайным образом излучающих световые волны. Понятно, что никакой согласованности по фазе между такими волнами нет. Для получения когерентных световых пучков применяют различные искусственные приемы, в основе которых лежит разделение одного и того же пучка на два, идущих впоследствии к какой-либо точке пространства (экрана) двумя различными путями. В зависимости от способа разбиения пучка существует два разных метода получения когерентных «источников»:
2) метод деления амплитуды, который предполагает деление пучка путем прохождения и отражения от полупрозрачной поверхности. Именно этот способ рассматривается в настоящем разделе; в результате чего получается интерференционная картина, называемая кольцами Ньютона.
Разделение луча (пучка) на два когерентных осуществляется путем его отражения от поверхностей тонкого прозрачного слоя (рис. 10): Пусть параллельный монохроматический пучок света от одного источника падает на клиновидный слой; выделим из него два луча - 1 и 2 (или любую другую пару лучей - 3 и 4). Проведем перпендикулярно лучам плоскость АЕ, которая является фронтом падающей волны (до плоскости АЕ два луча - 1 и 2, идущие от одного источника, дошли одновременно, а следовательно, имели нулевую разность фаз). От плоскости АЕ лучи прошли различные пути; в точке С произошло сложение колебаний, результат которого будет зависеть от разности фаз складывающихся волн.
Разность фаз связана с разностью хода δ лучей соотношением:
Длина волны падающего света;
оптическая разность хода лучей;
геометрическая разность хода лучей;
абсолютный показатель преломления
Оптическая разность хода δ лучей 1 и 2 в рассматриваемом случае выразится в виде:
Член π/2 возникает соответственно «потере» фазы (запаздыванию) на π при отражении света от оптически более плотного слоя диэлектрика в оптически менее плотный. Знак плюс или минус берется в зависимости от того, где происходит указанное отражение. Очевидно, в данном случае следует взять знак минус (клин находится в воздухе, отражение от более плотной среды происходит в точке С, следовательно, «теряет» фазу отраженный луч 2). Приблизительно полагая в формуле (40) АВ = ВС = = d и ЕС=0 (поскольку падающий пучок света узкий и все лучи 1, 2, 3, 4 и т. д. практически совпадают), получаем следующее выражение для оптической разности хода:
где d- толщина клина в точке В.
"Интерференционные максимумы и минимумы будут иметь такой вид:
2dn - =kλ = 2k (41a максимум );
2dn - = (2k-1) (41б минимум ),
где k = 0,1,2,...- порядок интерференционного максимума и минимума.
Из формул (41) видно, что всем точкам поверхности пластинки одинаковой толщины соответствует одна и та же интерференционная картина: максимумы или минимумы одинаковой интенсивности. Интерференционная картина имеет вид полос светлых и темных, их называют полосами (линиями) равной толщины. Этот вид интерференции называется интерференцией равной толщины. В случае клиновидного слоя полосы будут параллельны ребру клина (рис. 11). При использовании белого (полихроматического) света интерференционные полосы приобретают радужную окраску (всем известны цвета тонкой масляной или керосиновой пленки на воде или на стекле). Это происходит потому, что разность хода б (формулы (41)) зависит и от длины волны, а следовательно, при одной и той же толщине пластинки dмаксимумы и минимумы для волн различных длин будут несколько сдвинуты относительно друг друга.
Интерференцию можно также наблюдать в проходящем через пластинку свете.
В зависимости от формы пластинки меняется и форма интерференционных полос. Следует заметить, что в реальных условиях падающие лучи не идеально параллельны, грани пластинки искривлены, толщина неравномерно меняется, показатель преломления тоже, меняется на неоднородностях материала и т. д. По всем этим, многочисленным причинам будут наблюдаться причудливо изогнутые линии, вид которых дает возможность судить очень точно о толщине пластинки в данной точке или о неоднородностях материала (интерференционные методы измерения - одни из самых точных).
образуют концентрические окружности с темным пятном (минимумом) в середине. Эта интерференционная схема представляет собой схему колец Ньютона.
где r k - радиус интерференционного кольца - минимума k-того порядка;
R- радиус сферы линзы.
Так как обеспечить контакт в точке О (рис. 12) трудно вследствие попадания пылинок, то пользуются другой формулой, в которую входит комбинация из двух значений радиусов интерференционных колец r k и г г -, что позволяет исключать возможный зазор (т. е. реально существующее увеличение толщины всего воздушного слоя) в точке 0, Для i-того и k-того колец можно записать:
Вычтем почленно эти уравнения:
= (k - i) λR откуда
где k и i - порядки интерференционных колец.
Формула (46) остается одной и той же как для интерференционных минимумов, так и для максимумов.
Точность определения λ по формуле (46) зависит от того, насколько точно измерены r k и r i , а так как последние величины являются очень малыми, то для их измерения пользуются микроскопом. Кроме того, для понижения погрешности следует выбрать r k и r i таким образом, чтобы числа k и i были возможно дальше друг от друга.
ДИФРАКЦИОННАЯ РЕШЕТКА
Экспериментально установлено, что свет в однородной среде распространяется прямолинейно. Однако более детальные наблюдения показывают, что световая волна заходит в область геометрической тени, причем на границе между областями света и тени появляются максимумы и минимумы света, свидетельствующие о некотором перераспределении световой энергии на этой границе.
Огибание световой волной границ непрозрачных тел с образованием интерференционного перераспределения энергии по различным направлениям называется дифракцией света .
Дифракция - доказательство волновой природы света ; дифракция свойственна не только световым, но и вообще всяким волнам. Различают с некоторой степенью условности дифракцию сферических волн (дифракция Френеля) и дифракцию плоскопараллельных волн (дифракция Фраунгофера).
Расчет и объяснение дифракции света осуществляется на основе принципа Гюйгенса-Френеля. Согласно принципу Гюйгенса, каждую точку фронта волны можно рассматривать как самостоятельный вторичный источник сферических волн. Построив огибающую всех вторичных источников, находят положение фронта волны в любой последующий момент времени, тем самым определяют направление дальнейшего распространения света. Френель дополнил принцип Гюйгенса рядом интерференционных положений; он ввел представление о когерентности вторичных волн и их интерференции. Для того чтобы определить результат дифракции в некоторой точке пространства, следует рассчитать, согласно принципу Гюйгенса-Френеля, интерференцию вторичных волн,
 |
| Рис. 13 |
попавших в эту точку от волновой поверхности (фронта волны, в случае однородной среды).
В лабораторной практике дифракционную картину чаще всего получают от дифракционных решеток. Дифракционная решетка - оптическое устройство , представляющее собой совокупность большого числа параллельных, обычно равноотстоящих друг от друга щелей одинаковой формы. Плоская прозрачная дифракционная решетка - это прозрачная пластина с большим количеством (до 1000 на длине 1 мм) тонких параллельных щелей одинаковой ширины bи равными расстояниями dмежду их серединами (или соответственными точками).Расстояние d называется периодом или постоянной решетки. Условное обозначение дифракционной решетки показано на рис. 13.
На рис. 14 представлен ход лучей через решетку согласно схеме дифракции Фраунгофера. Параллельный пучок лучей 1, идущих от одного источника, падает на дифракционную решетку 2 перпендикулярно к ней. Эти лучи дифрагируют при прохождении через решетку, образуя (вторичные) когерентные расходящиеся пучки под углами дифракции φ 1 , φ 2 ,…φ k . Пучки, прошедшие объектив 3 зрительной трубы, дают в его фокальной плоскости 4 дифракционную картину, как результат дошедших до плоскости 4 когерентных колебаний. Получающееся изображение можно наблюдать с помощью объектива 5.
Распределение интенсивности в дифракционной картине получим, если учтем распределение интенсивностей при дифракции от одной щели, а также взаимную интерференцию волн от всех щелей. Известно, что каждая щель (в схеме наблюдения дифракции Фраунгофера от нее) дает дифракционную картину, представленную на рис. 15. При этом условие минимумов интенсивности, называемых в данном случае первичными, выражается в виде:
 |
φ m - угол дифракции;
λ - длина волны в данной среде.
Условие максимумов:
![]() ;
; ![]() ;
;
![]() ; … (47а)
; … (47а)
При дифракции от решетки (рис. 14) картины от всех щелей придутся на одно и то же место плоскости 4 (экрана), усиливая друг друга.
Учтем взаимную интерференцию когерентных колебаний, приходящих от различных щелей. Очевидно, условие минимума (47) для одной щели является также условием минимума для решетки: в этих направлениях φ условия «гашения» света выполняются для каждой щели в отдельности, а следовательно, и для всей решетки в целом. Кроме того, из рис. 14 видно, что разность хода Δ лучей, идущих от любых соответственно расположенных пар точек (например, центральных точек) соседних щелей, равна Δ = d sin φ; если эта разность хода кратна целому числу длин волн (четному числу полуволн), то при интерференции возникнут главные максимумы, определяемые условием (2):
![]() (48)
(48)
где k = 1, 2, 3, ... - порядок дифракционного максимума. Соотношение (48) называется основной формулой дифракционной решетки.
Амплитуда колебаний в точках фокальной плоскости 4 (рис. 14), соответствующих главным максимумам, равна
![]() (49)
(49)
где A φ - амплитуда колебаний, посылаемых одной щелью под утлом φ;
N - число щелей решетки.
 Рис. 15
Рис. 15
Известно, что интенсивность света I прямо пропорциональна квадрату амплитуды волны. Таким образом, интенсивность главных максимумов I макс, пропорциональна квадрату числа щелей решетки:
![]() (50)
(50)
где I φ - интенсивность, создаваемая одной щелью в направлении φ.
Можно доказать, что направления, для которых колебания от отдельных щелей взаимно погашают друг друга, т. е. добавочные минимумы удовлетворяют следующему условию:

(k΄ = 1, 2, …, N – 1, N + 1,…)
Между двумя главными максимумами возникает (N-1) минимумов. Между этими минимумами должны находиться побочные (дополнительные) максимумы, в которых интенсивность света при достаточно большом N пренебрежимо мала по сравнению с интенсивностью главных максимумов.
Результирующее распределение интенсивности в дифракционной картине от решетки представлено на рис. 16. Пунктирная кривая дает интенсивность от одной щели, умноженную на N 2 . Сплошная кривая соответствует главным максимумам, а также добавочным максимумам и минимумам.
С помощью дифракционной решетки можно анализировать свет, т. е. изучать его спектральный состав. Действительно, в том случае, когда источник излучает немонохроматический свет (например, белый), то решетка разлагает его в спектр. При φ 0 = 0 возникает максимум нулевого порядка, совпадающий для всех длин волн. По обе стороны от него возникнут спектры - максимумы порядков ±k. В спектре каждого порядка максимумы для более коротких волн расположатся ближе к нулевому максимуму. Максимумы для более длинных волн - дальше от него.
 Рис. 16
Рис. 16
Способность дифракционной решетки разлагать свет в спектр позволяет использовать ее как диспергирующее устройство в спектральных приборах.
Похожая информация.